1 概要
臨床試験のデザインや解析においては生物統計家の貢献が不可欠です。原則的な統計学的留意事項はプロトコルに記載しておくことが望ましいとされていますが、統計解析計画 (Statistical Analysis Plan; SAP) の記載に関してはICH E9やSPIRITといった標準的なプロトコル作成のガイドラインの間でも異なっている点が見られ、結果として試験ごとに統一されていないケースが多いというのが現状です。本稿では、2017年に公開された「Guidelines for the Content of Statistical Analysis Plans in Clinical Trials」の内容に基づき、臨床試験の統計関連業務に携わる全ての方に向けて統計解析報告書記述のヒントをまとめます。
2 終解析の時期
本稿では、「Guidelines for the Content of Statistical Analysis Plans in Clinical Trials」の「最終解析の時期 (Timing of final analysis)」についてまとめます。
2.1 臨床試験のための統計解析計画書の内容に関するガイドライン
「臨床試験のための統計解析計画書の内容に関するガイドライン」には最終解析の時期について以下のような記述がなされています。
| Timing of final analysis | 14 | Timing of final analysis, eg, all outcomes analyzed collectively or timing stratified by planned length of follow-up |
|---|---|---|
| 最終解析の時期 | 14 | ひとまとめ、あるいは計画された追跡期間で層別した時期別に、解析しようとするすべてのアウトカムを含める。 |
2.2 最終解析
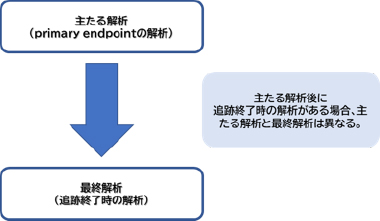
最終解析(final analysis)とは、プロトコルで規定された最終追跡(final follow-up survey)結果に基づいて行う解析のことを指します。
最終解析の時期に関して、全生存期間や無再発生存期間等のtime-to-event end pointがprimary endpointである第Ⅲ相試験で、主たる解析がプロトコルに規定された追跡期間終了時に行われる場合、「主たる解析=最終解析」となります。一方、主たる解析後に長期追跡を行う場合には、主たる解析と最終解析は異なることになります。例えば、がんの奏功割合がprimary endpointである第Ⅱ相試験の場合、主たる解析の後、追跡期間終了時に行われるtime-to-event end pointの解析が最終解析となるため、主たる解析と最終解析は異なることになります。
3 記載例
記載例は以下の通りです。
●追跡期間終了後、最終調査によりデータを確定した後にすべてのエンドポイントに対する解析を行う。なお本試験は登録終了●●年後を目処に行う主たる解析が最終解析となる。
4 参考文献
- Gamble C, Krishan A, Stocken D; CONSORT Group. Guidelines for the Content of Statistical Analysis Plans in Clinical Trials. JAMA. 2017; 318 (23): 2337-2343. (PMID: 29260229)
- 折笠秀樹, 訳. 臨床試験のための統計解析計画書の内容に関するガイドラインで示された「記載例」の紹介. 薬理と治療. 2018; 46 (4): 641-8.
- Japan Clinical Oncology Group. 主たる解析・最終解析と主要評価項目報告書・総括報告書. (http://www.jcog.jp/basic/policy/A_020_0010_25.pdf) (2021年9月28日アクセス可能)
- Japan Clinical Oncology Group. JCOGプロトコルマニュアル version 3.5.(http://www.jcog.jp/basic/policy/A_020_0010_14.pdf) (2021年9月28日アクセス可能)
ヒト臨床試験 (ヒト試験) で得られる結果は、様々な誤差を含んでいます。この誤差を小さくすることで介入効果を増大させることができます。オルトメディコは、多分野の専門家を有するため、様々なアプローチにより誤差を最小化する試験運営が可能です。引き続き、皆様にご満足いただけるような高品質なヒト試験を提供させていただきますので、今後ともどうぞ宜しくお願い申し上げます。
- ★問い合わせ★
-
-
①臨床試験のお見積りに関するお問い合わせ
HP: https://orthomedico.jp/contact.html
Mail: info@orthomedico.jp -
②臨床試験に参加したい方はコチラ
HP: https://www.go106.jp/ -
③機能性表示食品の届け出に関するお問い合わせ
HP: https://届出.com/
Mail: planning-department@orthomedico.jp -
④栄養計算に関するお問い合わせ
HP: https://www.cand.life/
Mail: info@CAND.life -
⑤研究会の開催に関するお問い合わせ
HP: https://はじめての研究会.jp/
Mail: info@hajiken.jp
-
①臨床試験のお見積りに関するお問い合わせ
